Фармаконагляд (ФН), який передбачає моніторинг безпеки лікарських засобів, має вирішальне значення для фармацевтичних компаній для забезпечення безпеки пацієнтів і дотримання нормативних вимог на глобальному рівні.

Однак орієнтуватися в складних місцевих нормативних актах у різних країнах може бути непросто.
Для міжнародних компаній, які виходять на білоруський ринок або розширюють свою діяльність на ньому, розуміння білоруської системи PVG має важливе значення для уникнення таких наслідків, як відкликання продукції, штрафи та репутаційна шкода від недотримання вимог.
Нормативно-правова база в Білорусі
Ключове законодавство та настанови з фармаконагляду в Білорусі
Система фармаконагляду в Білорусі регулюється кількома ключовими законодавчими актами та настановами, зокрема:
- Закон про лікарські засоби: Цей всеосяжний закон встановлює правову основу для регулювання обігу лікарських засобів в Білорусі, включаючи положення, що стосуються діяльності з фармаконагляду.
- Інструкція про порядок повідомлення про побічні реакції на лікарські засоби: Цей документ визначає конкретні вимоги та процедури повідомлення про побічні реакції (ПР) і серйозні побічні реакції (СПР), пов’язані із застосуванням лікарських засобів у Білорусі.
- Інструкція про порядок організації системи фармаконагляду: Ця інструкція містить рекомендації щодо створення та підтримки ефективної системи фармаконагляду у фармацевтичних компаніях, що здійснюють діяльність на території Білорусі.
- Прийняття Належної практики фармаконагляду (НПФ) Євразійського економічного союзу (ЄАЕС): Білорусь, як країна-член ЄАЕС, прийняла НПФ ЄАЕС, яка спрямована на гармонізацію практики фармаконагляду в країнах-членах союзу. Дотримання вимог GVP ЄАЕС є обов’язковим для компаній, що працюють на території Білорусі.
Регуляторні органи в Білорусі
Основним регуляторним органом, відповідальним за нагляд за системою фармаконагляду в Білорусі, є Міністерство охорони здоров’я. У структурі Міністерства Центр експертизи та випробувань в охороні здоров’я (ЦЕВ) відіграє вирішальну роль у впровадженні та забезпеченні дотримання правил ФНП.
CETH відповідає за
- Отримання, обробку та оцінку повідомлень про побічні реакції на лікарські засоби
- Проведення інспекцій та аудитів для забезпечення дотримання правил PVG
- Надання рекомендацій та підтримки фармацевтичним компаніям з питань, пов’язаних з PVG
- Співпраця з міжнародними організаціями та регуляторними органами з метою приведення у відповідність до найкращих світових практик
Майстер-файл системи фармаконагляду (PSMF) в Білорусі
GVP ЄАЕС вводить поняття майстер-файлу системи фармаконагляду (PSMF), комплексного документа, який описує систему фармаконагляду компанії та її відповідність вимогам GVP. Хоча PSMF ЄАЕС не є обов’язковою вимогою національного законодавства Білорусі, він вважається доповненням до існуючої документації.
Компанії, що працюють в Білорусі, повинні бути готові надати наступну інформацію про свої СУФМ:
- Місцезнаходження PSMF: Фізичне та/або електронне місцезнаходження, де зберігається та підтримується PSMF.
- Подання PSMF: Терміни та процедури подання PSMF до CETH за запитом.
- Оновлення ПУФ: Процеси регулярного оновлення та підтримки ПУФ для відображення змін у системі фармаконагляду компанії.
Таблиця 1: Ключове законодавство та настанови з фармаконагляду в Білорусі
| Законодавство/настанова | Опис |
| Закон про лікарські засоби | Встановлює правові рамки для регулювання лікарських засобів, включаючи положення щодо ПВЯ |
| Інструкція про повідомлення про побічні реакції | Описує вимоги та процеси повідомлення про побічні реакції та небажані явища |
| Інструкція з організації системи ПВК | Надає рекомендації щодо створення та підтримки ефективної системи ПВН |
| Належні практики фармаконагляду ЄАЕС (GVP) | Гармонізовані настанови, прийняті Білоруссю як країною-членом ЄАЕС |

Повідомлення про побічні реакції в Білорусі
Своєчасне і точне повідомлення про побічні реакції (ПР) і серйозні побічні реакції (СПР) є наріжним каменем ефективної системи фармаконагляду.
У Білорусі встановлені конкретні вимоги і процеси для забезпечення належного документування та передачі інформації з безпеки, пов’язаної з фармацевтичною продукцією.
Вимоги до звітності
Білоруські регуляторні органи затвердили стандартизовані форми для звітування про підозрювані АЕ та несподівані САЕ.
Ці форми призначені для збору необхідної інформації, в тому числі
- Дані пацієнта: Ініціали, номер медичної картки, вік, стать, вага та інша відповідна демографічна інформація.
- Інформація про заявника: Прізвище, ім’я, контактна інформація та місце роботи медичного працівника або споживача, який повідомляє про подію.
- Інформація про продукт: назва підозрюваного продукту, номер серії/лота, спосіб застосування, показання та інформація про дозування.
- Опис події: Детальний опис несприятливої події, включаючи дату початку, тривалість, тяжкість, а також будь-яку відповідну історію хвороби або супутні ліки.
Для компаній вкрай важливо забезпечити точний збір та подання всіх необхідних елементів даних для дотримання вимог місцевого законодавства.
Терміни подання звітності в Білорусі
У Білорусі існують такі строки для повідомлення про АЕ та САЕ:
- Серйозні побічні реакції (СПР): Компанії повинні подавати прискорені звіти про непередбачувані серйозні побічні реакції протягом 15 календарних днів з моменту, коли їм стало відомо про подію.
- Несерйозні побічні реакції: Звіти з несерйозних побічних явищ слід включати до Періодичного звіту з безпеки (ПЗБ).
- Періодичні звіти з оновленої інформації з безпеки (PSUR): Звіти з періодичного оновлення безпеки повинні подаватися відповідно до встановлених термінів, які можуть відрізнятися залежно від продукту та його класифікації за ступенем ризику. CETH надає конкретні вказівки щодо термінів подання PSUR під час процесу реєстрації продукту.
Компанії повинні мати надійні процеси для забезпечення своєчасного виявлення, оцінки та звітування про АЕ та САЕ, щоб дотриматися цих нормативних термінів.
Захист даних і конфіденційність у Білорусі
У GVP ЄАЕС та національному законодавстві Білорусі підкреслюється важливість захисту персональних даних та дотримання конфіденційності при роботі з інформацією з фармаконагляду.
Компанії, що працюють в Білорусі, повинні впровадити наступні заходи:
- Захист персональних даних: Забезпечити обробку всіх персональних даних, зібраних під час процесу звітування про АЕ, відповідно до законодавства про захист даних, включаючи отримання необхідних згод та впровадження відповідних заходів безпеки.
- Заходи конфіденційності: Запровадити протоколи для збереження конфіденційності інформації, про яку повідомляється, під час передачі та зберігання даних, наприклад, безпечні електронні системи, зашифровані канали зв’язку та обмежений доступ до конфіденційних даних.
Недотримання вимог щодо захисту даних та конфіденційності може призвести до значних штрафів та правових наслідків.

Канали звітності для звітів з АЕ та SAE в Білорусі
Усі звіти про АЕ та ПОР у Білорусі повинні подаватися до ЦОВВ, уповноваженого регуляторного органу, відповідального за отримання та обробку даних з фармаконагляду. Наразі звіти можна подавати наступними способами:
- Звітність на паперових носіях: Компанії можуть подавати заповнені форми звітності AE та SAE поштою або особисто до офісу CETH.
- Електронна звітність: Хоча ще не повністю впроваджена, Білорусь вивчає можливість розробки системи електронної звітності для оптимізації подання та обробки даних з фармаконагляду.
У міру впровадження електронної звітності компанії повинні бути готові адаптувати свої процеси та системи до нових вимог та інструкцій, виданих CETH.
Контрольний список звітності для Білорусі
[ ] Використовуйте затверджені форми звітності AE та SAE
[Точно фіксувати всі необхідні елементи даних
[ ] Дотримуватися прискорених термінів звітування про SAE (15 календарних днів)
[ ] Включати несерйозні АП до Періодичних звітів з оновлення безпеки (PSUR)
[ ] Впровадити заходи щодо захисту персональних даних та збереження конфіденційності
[ ] Подавати звіти до CETH через затверджені канали (наразі на паперових носіях або особисто)
[ ] Стежити за оновленнями щодо впровадження електронної системи звітності
Дотримуючись цих вимог до звітності та найкращих практик, міжнародні компанії можуть забезпечити дотримання зобов’язань щодо звітності про побічні реакції в Білорусі та зробити свій внесок у загальну мету забезпечення безпеки пацієнтів.
Порівняння Білорусі з практикою GVP ЄС
Хоча прийнята в Білорусі GVP ЄАЕС значною мірою гармонізована з настановами Європейського Союзу (ЄС), існують деякі помітні відмінності у впровадженні та специфічних вимогах до системи фармаконагляду.
Сфери гармонізації з GVP ЄС:
- Прийняття подібних принципів і процесів для звітування про АЕ, виявлення сигналів та управління ризиками
- Наголос на захисті даних та заходах конфіденційності
- Вимоги до основного файлу системи фармаконагляду (PSMF)
Ключові відмінності:
- Відсутність єдиної бази даних ПВГ ЄАЕС: На відміну від системи ЄС EudraVigilance, ЄАЕС не має централізованої бази даних з фармаконагляду. Звіти, що надходять з однієї країни ЄАЕС, повинні подаватися індивідуально до інших країн-членів.
- Потенційні відмінності у строках подання PSUR: У той час як ЄС встановив строки подання PSUR на основі класифікації ризиків для продуктів, Білорусь може мати інші строки для конкретних продуктів під час національного процесу реєстрації.
- Місцеві форми та вимоги: Білорусь має власні затверджені на місцевому рівні форми та специфічні вимоги до даних для звітності з АЕ та SAE, які можуть дещо відрізнятися від форм ЄС.
- Національний чи централізований процес отримання дозволу на маркетинг: На відміну від централізованої процедури видачі реєстраційних посвідчень в ЄС, Білорусь дотримується національного процесу реєстрації лікарських засобів, що може впливати на вимоги та терміни здійснення фармаконагляду.
Таблиця 2: Порівняння практик фармаконагляду в ЄАЕС та ЄС
| Аспект | ЄАЕС (+ Білорусь) | Європейський Союз |
| Керівні принципи | ВАЛОВИЙ ВНУТРІШНІЙ ПРОДУКТ ЄАЕС | ВАЛОВИЙ ВНУТРІШНІЙ ПРОДУКТ ЄС |
| Централізована база даних | Єдиної бази даних немає | EudraVigilance |
| Часові діаграми PSUR | Різниця потенціалів | Гармонізовано на основі ризику продукту |
| Форми звітності | Місцеві форми | Форми ЄС |
| Дозвіл на маркетинг | Національний процес | Централізована процедура |
Інспекції та аудити фармацевтичних компаній у Білорусі
Для забезпечення дотримання правил фармаконагляду CETH проводить регулярні інспекції та аудити фармацевтичних компаній, що працюють в Білорусі.
Регуляторні перевірки CETH:
- CETH має повноваження проводити інспекції на місцях для оцінки системи та процесів фармаконагляду компанії.
- Інспекції можуть бути плановими або ініційованими певними подіями, такими як занепокоєння щодо безпеки продукції або невідповідності вимогам.
- Обсяг перевірок може охоплювати різні аспекти, зокрема процедури звітування про АЕ, обслуговування PSMF, діяльність з управління ризиками та цілісність даних.
Підготовка до інспекцій PVG:
- Компанії повинні підтримувати готовність до інспекцій, регулярно переглядаючи та оновлюючи свою документацію з фармаконагляду, процеси та навчальні програми.
- Проведення внутрішніх аудитів та імітаційних перевірок може допомогти виявити потенційні прогалини та сфери для вдосконалення перед регуляторною перевіркою.
- Призначення спеціальної команди або персоналу, відповідального за координацію та сприяння перевіркам, може впорядкувати цей процес.
Роль аудитів у забезпеченні дотримання вимог GVP:
- На додаток до регуляторних перевірок, компанії повинні впровадити надійну програму внутрішнього аудиту для постійного моніторингу та оцінки ефективності своєї системи фармаконагляду.
- Аудит може виявити сфери невідповідності, неефективність процесів та можливості для вдосконалення, що дозволяє компаніям проактивно вживати коригувальні та превентивні заходи.
- Регулярні аудити демонструють прихильність компанії до якості та дотримання вимог, що може бути корисним під час регуляторних перевірок.

Виклики та кращі практики фармаконагляду в Білорусі
Робота на білоруському ринку ставить перед міжнародними фармацевтичними компаніями унікальні виклики, що вимагають стратегічного підходу та дотримання найкращих практик.
Мовні бар’єри та культурні відмінності:
- Компанії повинні бути готовими до подолання мовних бар’єрів та культурних відмінностей при взаємодії з місцевими регуляторними органами та медичними працівниками.
- Використання місцевих ресурсів або партнерство з досвідченими консультантами з регуляторних питань може допомогти подолати ці розбіжності та забезпечити ефективну комунікацію.
Забезпечення узгодженої глобальної звітності:
- Підтримання узгодженої практики звітування на різних ринках має вирішальне значення для ефективного здійснення фармаконагляду та дотримання регуляторних вимог.
- Компанії повинні запровадити стандартизовані глобальні процеси та системи для звітування про НЯ, виявлення сигналів та управління ризиками, враховуючи при цьому місцеві вимоги.
Підтримання готовності до перевірок:
- Регуляторні перевірки можуть відбуватися з мінімальним попередженням, тому компаніям важливо постійно підтримувати стан готовності до перевірок.
- Регулярні тренінги, аналіз процесів та імітація перевірок можуть допомогти виявити та усунути потенційні прогалини або невідповідності.
Використання технологій та автоматизації:
- Впровадження надійного програмного забезпечення та автоматизованих систем фармаконагляду може впорядкувати процеси, підвищити точність даних і поліпшити дотримання термінів подання звітності.
- Оскільки Білорусь вивчає можливості електронної звітності, компанії повинні бути готові до відповідної адаптації своїх систем і процесів.
Важливість місцевої регуляторної інформації:
- Бути в курсі останніх регуляторних змін, керівних документів та найкращих галузевих практик у Білорусі має вирішальне значення для забезпечення дотримання вимог законодавства.
- Спілкування з місцевими регуляторними експертами, відвідування галузевих заходів та моніторинг офіційних повідомлень можуть надати цінну інформацію та аналітику.
Блок-схема: Процес звітування про АЕ в Білорусі
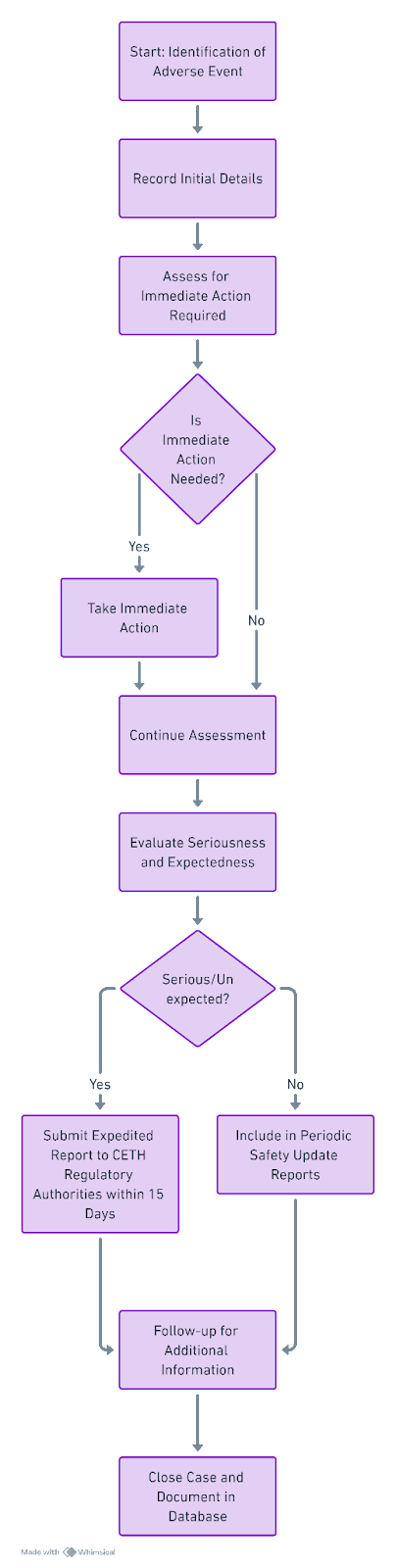
Ключові терміни та визначення GVP:
- Небажана подія (НП): Будь-який несприятливий медичний випадок у пацієнта, який приймав лікарський засіб, що не обов’язково має причинно-наслідковий зв’язок з лікуванням.
- Серйозна несприятлива подія (НПП): ПР, що призводить до смерті, загрожує життю, вимагає госпіталізації або продовження існуючої госпіталізації, призводить до стійкої або значної інвалідності/недієздатності або є вродженою аномалією/вродженим дефектом.
- Періодичний звіт з оновлюваної інформації з безпеки (PSUR): Періодичний звіт, який узагальнює світовий досвід з безпеки лікарського засобу, включаючи всі зареєстровані ПР та оцінки співвідношення ризик/користь.
- Основний файл системи фармаконагляду (PSMF): Детальний документ, який описує систему фармаконагляду та її відповідність вимогам GVP.
Маєте запитання щодо системи ФН в Білорусі?
Міжнародні фармацевтичні компанії можуть знайти місцевий досвід неоціненним при навігації в білоруських регуляторних процедурах і процедурах фармаконагляду. Спеціалізовані агентства, такі як Delta Medical, з офісами по всьому регіону Євразії, включаючи Білорусь, Азербайджан та Вірменію, Україну, Молдову та Центральну Азію, мають всі можливості для того, щоб допомогти компаніям у виконанні нюансів регуляторних вимог.
Наша присутність у Мінську, зв’язки з органами охорони здоров’я та досвід подання документів до регіональних регуляторних органів полегшують роботу на цих ринках, що розвиваються, і дозволяють компаніям зосередити основні зусилля на розробці та комерціалізації лікарських засобів. Наші цілеспрямовані рекомендації, що доповнюють ваші внутрішні можливості, є ключем до ефективного виконання вимог Білорусі та забезпечення безпеки пацієнтів.
Як швейцарська фармацевтична компанія, Delta Medical може також займатися маркетингом, логістикою, дистрибуцією та продажами, щоб допомогти компаніям досягти успішної комерціалізації на цих ринках.
Часті запитання про фармаконагляд в Білорусі
Які основні закони та настанови з фармаконагляду діють у Білорусі?
- Закон “Про лікарські засоби
- Інструкція про порядок здійснення повідомлень про побічні реакції
- Інструкція з організації системи фармаконагляду
- Прийняття Належних практик фармаконагляду Євразійського економічного союзу (ЄАЕС) (GVP)
Яка роль Центру експертизи та випробувань у сфері охорони здоров’я (ЦЕВ)?
Які вимоги та форми повідомлень про побічні реакції існують у Білорусі?
Які терміни повідомлення про несприятливі події в Білорусі?
- Серйозні ПР: 15 календарних днів
- Несерйозні ПП: Включаються до Періодичних звітів з оновлення безпеки (PSUR)
- PSUR: Терміни залежать від класифікації ризику продукту