В Азербайджане с населением около 10 миллионов человек и развивающимся сектором здравоохранения наблюдается постоянный рост спроса на высококачественные лекарства и медицинские товары.

Регистрация фармацевтических препаратов может быть сложной задачей для международных менеджеров по регуляторным вопросам, которые не знакомы с особыми требованиями и процедурами страны. Чтобы успешно зарегистрировать и вывести на рынок фармацевтическую продукцию в Азербайджане, очень важно хорошо понимать нормативно-правовую базу, основные органы власти и поэтапный процесс регистрации.
Мы надеемся предоставить международным менеджерам по регуляторным вопросам необходимую информацию, чтобы уверенно выйти на азербайджанский рынок и оптимизировать свои усилия по регистрации продукции.
К концу данного руководства читатели будут иметь четкое представление о:
- Основные регулирующие органы и их роль в регистрации лекарственных средств
- Законодательная база, регулирующая лекарственные средства в Азербайджане
- Виды фармацевтической продукции, подлежащей регистрации
- Стандартные и ускоренные процедуры регистрации и их требования
- Пострегистрационные обязательства и требования к фармаконадзору
- Маркировка, упаковка и правила импорта/экспорта
- Рекомендации по успешному выходу на рынок и соблюдению требований
Регулирующие органы и законодательная база в Азербайджане
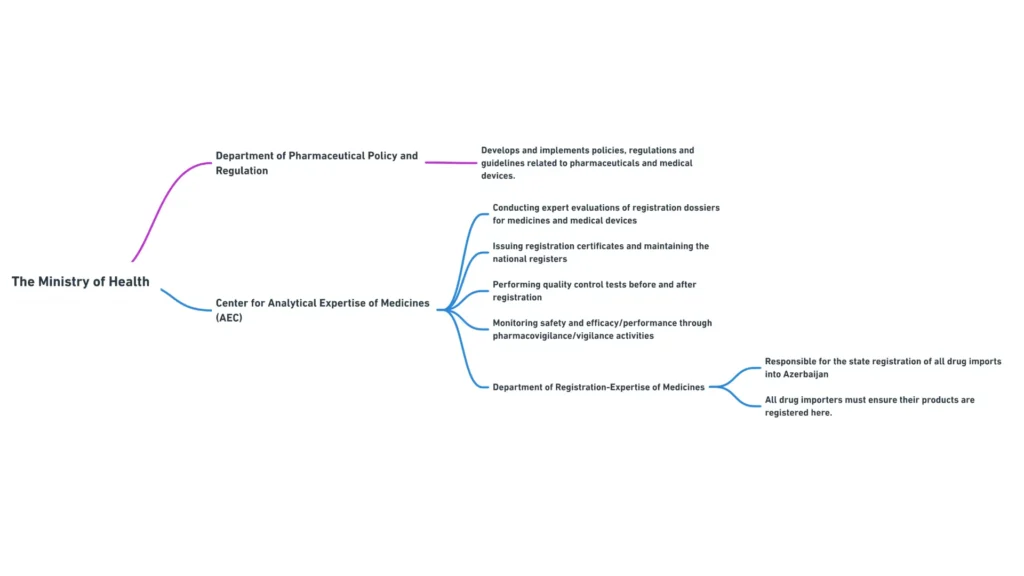
Министерство здравоохранения Азербайджанской Республики
Министерство здравоохранения Азербайджанской Республики является основным регулирующим органом, ответственным за надзор за сектором здравоохранения, включая регулирование фармацевтической продукции. Основные обязанности Министерства включают:
- разработка и реализация национальной политики и стратегий, связанных со здравоохранением и фармацевтикой
- Выдача лицензий на фармацевтическую деятельность, такую как производство, импорт и оптовая торговля
- надзор за регистрацией, контролем качества и безопасностью лекарственных средств
- координация действий с другими государственными учреждениями и международными организациями по вопросам здравоохранения.
В состав Министерства здравоохранения входит несколько департаментов и подчиненных им органов, которые играют определенную роль в регулировании фармацевтической деятельности. Наиболее актуальными для менеджеров по международным регуляторным вопросам являются следующие департаменты:
- Департамент фармацевтической политики и регулирования: Отвечает за разработку и внедрение фармацевтической политики, правил и рекомендаций.
- Департамент лицензирования и сертификации: Занимается лицензированием фармацевтической деятельности и сертификацией фармацевтических специалистов
- Департамент международных отношений: Координирует взаимодействие Министерства с международными организациями и зарубежными регулирующими органами
Министерство здравоохранения Азербайджана и департаменты, занимающиеся фармацевтическими препаратами
Центр аналитической экспертизы лекарственных средств
Центр аналитической экспертизы лекарственных средств является подведомственным учреждением Министерства здравоохранения, играющим важную роль в регистрации и контроле качества фармацевтической продукции в Азербайджане. К основным функциям Центра относятся:
- Проведение экспертизы регистрационных досье на лекарственные средства
- Выдача регистрационных удостоверений и ведение национального реестра лекарственных средств
- Проведение испытаний по контролю качества фармацевтической продукции до и после регистрации
- Мониторинг безопасности и эффективности зарегистрированных лекарственных средств с помощью мероприятий по фармаконадзору.
Центр аналитической экспертизы лекарственных средств является основным контактным лицом для международных менеджеров по регуляторным вопросам в процессе регистрации. Очень важно поддерживать четкую связь с Центром и оперативно отвечать на любые запросы или просьбы о предоставлении дополнительной информации, чтобы обеспечить беспрепятственный процесс регистрации.
Соответствующее законодательство и нормативные акты
Законодательная база, регулирующая фармацевтическую деятельность в Азербайджане, состоит из законов, указов и постановлений, которые устанавливают требования и процедуры регистрации, производства, импорта и распространения лекарственных средств.
Наиболее важные законодательные акты, о которых должны знать международные менеджеры по регуляторным вопросам, включают:
- Закон о лекарственных средствах (2006 г.) : основной закон, регулирующий фармацевтическую продукцию в Азербайджане, который охватывает такие аспекты, как регистрация, производство, контроль качества и фармаконадзор. С момента принятия закона в него было внесено несколько поправок для приведения в соответствие с международными стандартами и передовой практикой.
- Указ № 108 «О правилах государственной регистрации лекарственных средств» (2007 г.): Описывает подробные требования и процедуры регистрации фармацевтической продукции, включая содержание регистрационных досье, сроки и сборы.
- Постановление № 137 о правилах проведения экспертизы лекарственных средств (2007 г.): Определяет процедуры и критерии экспертной оценки регистрационных досье Центром аналитической экспертизы лекарственных средств.
- Постановление № 137 о правилах импорта и экспорта лекарственных средств (2007): устанавливает требования и процедуры импорта и экспорта фармацевтической продукции, включая лицензирование, таможенное оформление и документацию.
Помимо этих ключевых законодательных актов, менеджеры по международным регуляторным вопросам должны быть в курсе всех поправок, дополнительных правил или руководящих документов, выпущенных Министерством здравоохранения или Центром аналитической экспертизы лекарственных средств.
Регулярное обращение к официальным сайтам и информационным бюллетеням этих органов может помочь обеспечить соблюдение самых современных требований.
Виды фармацевтической продукции, подлежащей регистрации
В Азербайджане большинство фармацевтических продуктов должны быть зарегистрированы в Центре аналитической экспертизы лекарственных средств, прежде чем они будут допущены к продаже. Требование регистрации распространяется как на импортные, так и на отечественные препараты.
К основным видам фармацевтической продукции, подлежащей регистрации, относятся:
- Оригинальные лекарственные средства: инновационные фармацевтические продукты, содержащие новые активные вещества или новые комбинации активных веществ, которые ранее не были зарегистрированы в Азербайджане.
- Генерические лекарственные средства: Фармацевтические препараты, содержащие те же активные вещества, лекарственную форму и силу, что и уже зарегистрированный оригинальный препарат, и предназначенные для взаимозаменяемости с оригинальным препаратом.
- Комбинированные препараты: Лекарственные средства, содержащие два или более активных вещества в комбинации с фиксированной дозой, где каждое активное вещество вносит свой вклад в общий терапевтический эффект.
- Фармацевтические формы и дозировки: Различные лекарственные формы (например, таблетки, капсулы, сиропы) и дозировки одного и того же действующего вещества требуют отдельной регистрации, даже если они произведены одним и тем же производителем.
Однако некоторые виды фармацевтической продукции могут быть освобождены от требования регистрации, например:
- Лекарства, приготовленные в аптеках по рецепту врача для отдельных пациентов
- Лекарства, ввозимые для личного пользования в количествах, не превышающих установленный лимит
- Лекарства, импортируемые для проведения клинических испытаний или научных исследований, с предварительного разрешения Министерства здравоохранения.
Международным менеджерам по регуляторным вопросам необходимо тщательно оценить свой портфель продуктов и определить, какие продукты требуют регистрации в Азербайджане. Эта оценка должна учитывать такие факторы, как состав, предполагаемое использование и потенциальный рыночный спрос на каждый продукт.
| Тип продукта | Требование к регистрации |
| Оригинальные лекарства | Да |
| Дженерики | Да |
| Комбинированные продукты | Да |
| Различные лекарственные формы и дозировки | Требуется отдельная регистрация |
| Лекарства, приготовленные в аптеках для отдельных пациентов | Освобожденные |
| Лекарства, ввозимые для личного пользования (ограниченное количество) | Исключено |
| Лекарства, ввозимые для клинических испытаний или исследований (с разрешения) | Исключение |
Процедуры и сроки регистрации фармацевтических препаратов в Азербайджане
Чтобы зарегистрировать фармацевтический продукт в Азербайджане, международные менеджеры по регуляторным вопросам должны пройти соответствующую процедуру регистрации и представить полное досье в Центр аналитической экспертизы лекарственных средств.
Процесс регистрации состоит из двух основных процедур: стандартной процедуры регистрации и ускоренной процедуры регистрации.
Стандартная процедура регистрации фармацевтической продукции в Азербайджане
Стандартная процедура регистрации — самый распространенный путь</a> для регистрации фармацевтической продукции в Азербайджане. Эта процедура включает в себя тщательную оценку качества, безопасности и эффективности продукта Центром аналитической экспертизы лекарственных средств .
Ниже перечислены основные этапы и требования стандартной процедуры регистрации:
- Подача досье: Заявитель должен представить полное регистрационное досье в Центр аналитической экспертизы лекарственных средств. Досье должно быть подготовлено в соответствии с форматом Единого технического документа (CTD) и включать следующие модули:
- Административная информация (Модуль 1)
- Данные о качестве (Модуль 2)
- Неклинические данные (Модуль 3)
- Клинические данные (Модуль 4)
- Фармаконадзор и план управления рисками (Модуль 5)
- Досье должно быть представлено как в печатном, так и в электронном виде, вместе с требуемым регистрационным взносом.
- Предварительная экспертиза: После получения досье Центр аналитической экспертизы лекарственных средств проводит предварительную экспертизу, чтобы убедиться, что заявка полна и соответствует формальным требованиям. Если будут выявлены какие-либо недостатки, заявитель будет уведомлен и ему будет предоставлен определенный срок для их устранения.
- Специализированная экспертиза: После того как досье проходит предварительную экспертизу, оно подвергается специализированной экспертизе, которая включает в себя детальную оценку качества, безопасности и эффективности продукта группой экспертов. Этот этап может включать в себя:
- оценку фармацевтической и аналитической документации
- Анализ отчетов о неклинических и клинических исследованиях
- Оценка соотношения пользы и риска продукта
- Проверка производственного участка (участков) на соответствие требованиям надлежащей производственной практики (GMP).
- На этом этапе Центр аналитической экспертизы лекарственных средств может запросить у заявителя дополнительную информацию или разъяснения. Очень важно быстро и подробно ответить на эти запросы, чтобы избежать задержек в процессе регистрации.
- Решение и выдача свидетельства: На основании результатов специализированной экспертизы Центр аналитической экспертизы лекарственных средств принимает решение об одобрении или отклонении заявки на регистрацию. В случае положительного решения заявитель получает регистрационное удостоверение, действительное в течение пяти лет. Зарегистрированный препарат также будет включен в национальный реестр лекарственных средств.
Стандартная процедура регистрации обычно занимает от 6 до 12 месяцев с момента подачи досье до выдачи регистрационного удостоверения.
Однако эти сроки могут варьироваться в зависимости от сложности препарата, качества поданного досье и загруженности Центра аналитической экспертизы лекарственных средств.
Ускоренная процедура регистрации в Азербайджане
В июле 2020 года Азербайджан ввел ускоренную процедуру регистрации для упрощения процесса регистрации некоторых категорий фармацевтической продукции. Эта процедура направлена на сокращение сроков регистрации при обеспечении качества, безопасности и эффективности продукции.
Чтобы получить право на ускоренную процедуру регистрации, фармацевтический продукт должен соответствовать одному из следующих критериев:
- Продукт уже зарегистрирован в странах с жесткими нормативными требованиями (например, в ЕС, США, Японии, Австралии, Канаде).
- Продукт предварительно квалифицирован Всемирной организацией здравоохранения (ВОЗ)
- Продукт предназначен для лечения редких заболеваний или состояний с высокими неудовлетворенными медицинскими потребностями.
В рамках ускоренной процедуры регистрации Центр аналитической экспертизы лекарственных средств будет в приоритетном порядке оценивать соответствующие требованиям продукты и стремиться завершить процесс регистрации в течение 3-6 месяцев.
Однако заявитель все равно должен представить полное регистрационное досье и оперативно отвечать на любые запросы или просьбы властей о предоставлении дополнительной информации.
Важно отметить, что процедура ускоренной регистрации не освобождает продукцию от требования продемонстрировать качество, безопасность и эффективность. Применяются те же научные и технические стандарты, что и при стандартной процедуре регистрации.
Отказ в регистрации фармацевтической продукции в Азербайджане
В некоторых случаях Центр аналитической экспертизы лекарственных средств может отказать в регистрации фармацевтической продукции. Наиболее распространенные основания для отказа включают:
- Недостаточные или неадекватные данные, подтверждающие качество, безопасность или эффективность продукта
- Несоблюдение надлежащей производственной практики (GMP) или других соответствующих стандартов
- Искажение или фальсификация информации в регистрационном досье
- неустранение недостатков или непредоставление дополнительной информации по запросу органов власти в установленные сроки.
В случае отказа в регистрации заявитель получает письменное уведомление с указанием причин отказа. Заявитель может обжаловать это решение в течение 30 дней , подав письменный запрос в Министерство здравоохранения.
Апелляция будет рассмотрена экспертной комиссией более высокого уровня, которая примет окончательное решение по заявке на регистрацию.
Изменения в зарегистрированных фармацевтических препаратах
После регистрации фармацевтического продукта в Азербайджане любые изменения</a> в составе продукта, процессе производства, маркировке или других аспектах должны быть сообщены</a> в Центр аналитической экспертизы лекарственных средств.
Тип изменения определяет, требуется ли уведомление</a> или перерегистрация.
Типы изменений, требующих уведомления или перерегистрации
- Изменения состава и производства:
- Незначительные изменения в составе или процессе производства, не влияющие на качество, безопасность или эффективность продукта, могут потребовать только уведомления властей.
- Значительные изменения, такие как добавление или удаление активного вещества, существенное изменение процесса производства или изменение места производства, могут потребовать перерегистрации.
- Изменения в маркировке и упаковке:
- Незначительные изменения маркировки или упаковки, такие как обновление контактной информации производителя или добавление штрих-кода, могут потребовать только уведомления.
- Значительные изменения, такие как модификация названия, показаний, дозировки или условий хранения, могут потребовать перерегистрации.
- Показания и противопоказания:
- Любые изменения в утвержденных показаниях, противопоказаниях или других аспектах рецептурной информации продукта требуют повторной регистрации.
Процедура подачи запросов на внесение изменений в регуляторные документы в Азербайджане
Чтобы уведомить Центр аналитической экспертизы лекарственных средств об изменении или запросить перерегистрацию, держатель разрешения на маркетинг должен подать письменное заявление вместе с подтверждающей документацией.
В заявлении необходимо четко описать характер и объем изменений и предоставить доказательства того, что изменения не окажут негативного влияния на качество, безопасность или эффективность продукта.
Центр аналитической экспертизы лекарственных средств рассмотрит заявку на изменение и примет решение о том, одобрить ли изменение или запросить дополнительную информацию. Сроки рассмотрения варьируются в зависимости от сложности изменения и загруженности органов.
| Тип изменения | Уведомление | Перерегистрация |
| Незначительные изменения состава или производства | ✓ | |
| Значительные изменения в составе или производстве | ✓ | |
| Незначительные изменения в маркировке или упаковке | ✓ | |
| Значительные изменения в маркировке или упаковке | ✓ | |
| Изменения в показаниях или противопоказаниях | ✓ |
Несоблюдение требований по уведомлению об изменениях или перерегистрации может привести к штрафам, приостановке или аннулированию регистрации продукта.
Продление и аннулирование регистрации фармацевтических препаратов
В Азербайджане регистрация фармацевтического продукта действительна в течение пяти лет с даты выдачи регистрационного удостоверения. Чтобы продолжить маркетинг продукта после истечения срока действия регистрации, держатель разрешения на маркетинг должен подать заявку на продление.
Процесс подачи заявки на продление и требования в Азербайджане
Заявление на продление регистрации должно быть подано в Центр аналитической экспертизы лекарственных средств не менее чем за 90 дней до истечения срока действия текущей регистрации.
Заявка должна включать следующие документы:
- Заполненный бланк заявления на продление регистрации
- Копия действующего регистрационного удостоверения
- Обновленные данные о качестве, безопасности и эффективности, включая:
- Периодические отчеты об обновлении данных по безопасности (PSUR)
- Данные постмаркетингового наблюдения
- Любые новые клинические или неклинические исследования, проведенные с момента первоначальной регистрации
- Декларация, подтверждающая неизменность состава, процесса производства и других аспектов продукта, или подробное описание любых изменений, внесенных с момента первоначальной регистрации
- Образцы продукта и референтные стандарты для проверки контроля качества, если они запрошены властями.
Центр аналитической экспертизы лекарственных средств рассмотрит заявку на продление и примет решение о предоставлении продления</a> в течение 60 дней. Если властям потребуется дополнительная информация или разъяснения, срок рассмотрения может быть продлен.
Основания для отмены регистрации фармацевтической продукции
Центр аналитической экспертизы лекарственных средств может отменить регистрацию фармацевтического продукта при следующих обстоятельствах:
- Держатель разрешения на маркетинг не подал заявку на продление до истечения срока действия текущей регистрации
- Продукт признан небезопасным, неэффективным или некачественным на основании данных постмаркетингового наблюдения или других доказательств
- Держатель разрешения на маркетинг не соблюдает обязательства по фармаконадзору или другие пострегистрационные требования
- продукт не продается в Азербайджане в течение трех лет подряд без уважительной причины
- Держатель разрешения на маркетинг просит отменить регистрацию.
Если Центр аналитической экспертизы лекарственных средств намеревается отменить регистрацию продукта, он письменно уведомляет об этом владельца разрешения на продажу, излагая причины предлагаемой отмены.
Держатель разрешения на маркетинг имеет правообжаловать это решение в течение 30 дней, подав письменный запрос в Министерство здравоохранения.
Последствия непродления или аннулирования регистрации
Если регистрация фармацевтического продукта не продлевается или аннулируется, держатель разрешения на маркетинг должен:
- Прекратить всю деятельность по маркетингу и распространению продукта в Азербайджане
- Изъять продукт с рынка в сроки, установленные властями
- Уведомить медицинских работников и другие соответствующие заинтересованные стороны о невозобновлении или отмене препарата
- Сотрудничать с властями при проведении любого отзыва или других мер по снижению риска, которые будут сочтены необходимыми для защиты здоровья населения.
Несоблюдение этих обязательств может повлечь за собой наказание, включая штрафы и судебные иски.
Фармаконадзор и постмаркетинговые обязательства
Для обеспечения постоянной безопасности и эффективности зарегистрированных фармацевтических продуктов владельцы разрешений на маркетинг в Азербайджане должны соблюдать требования фармаконадзора и другие постмаркетинговые обязательства.
Требования к системе фармаконадзора в Азербайджане
Владельцы разрешений на маркетинг должны создать и поддерживать систему фармаконадзора, соответствующую требованиям, изложенным в Законе о лекарственных средствах и соответствующих нормативных актах.
Основные элементы системы фармаконадзора включают:
- Назначение местного контактного лица: Держатель разрешения на продажу должен назначить квалифицированное лицо, ответственное за фармаконадзор (QPPV), проживающее в Азербайджане и являющееся основным контактным лицом для органов власти по вопросам фармаконадзора.
- Отчетность о неблагоприятных событиях: Держатель разрешения на маркетинг должен сообщать обо всех серьезных неблагоприятных событиях, связанных с использованием его продукции в Азербайджане, в Центр аналитической экспертизы лекарственных средств в течение 15 дней с момента получения информации. О несерьезных нежелательных явлениях необходимо сообщать в течение 90 дней.
- Обнаружение сигналов и управление рисками: Держатель разрешения на продажу должен постоянно отслеживать профиль безопасности своей продукции и выявлять любые новые риски или изменения в балансе польза-риск. В случае обнаружения нового сигнала безопасности владелец разрешения на продажу должен уведомить об этом органы власти и принять соответствующие меры по управлению рисками.
Периодические отчеты об обновлении данных по безопасности (PSURs)
Владельцы разрешений на маркетинг должны представлять периодические отчеты об обновлении безопасности (PSUR) в Центр аналитической экспертизы лекарственных средств в соответствии со следующим графиком:
- Каждые 6 месяцев в течение первых 2 лет после регистрации
- Ежегодно в течение следующих 2 лет
- После этого — каждые 3 года
PSUR должны содержать всесторонний обзор профиля безопасности продукта, включая анализ всех нежелательных явлений, о которых сообщалось во всем мире, любые выявленные новые сигналы безопасности и любые изменения в соотношении пользы и риска.
Инспекции и аудиты держателей разрешений на маркетинг
Центр аналитической экспертизы лекарственных средств может проводить инспекции и аудиты держателей разрешений на маркетинг для обеспечения соблюдения требований фармаконадзора и других постмаркетинговых обязательств.
В ходе инспекции или аудита власти могут проверить систему фармаконадзора держателя разрешения на маркетинг, процессы отчетности о неблагоприятных событиях, планы управления рисками и другую соответствующую документацию.
Держатели разрешений на маркетинг должны в полной мере сотрудничать с органами власти во время инспекций и аудитов и оперативно устранять любые выявленные недостатки или несоответствия.
Штрафы за несоблюдение требований
Несоблюдение требований фармаконадзора и других постмаркетинговых обязательств может повлечь за собой штрафные санкции, в том числе:
- Штрафы и административные санкции
- Приостановление или аннулирование регистрации продукта
- Уголовное преследование в случае серьезного несоблюдения или мошенничества.
Чтобы избежать этих последствий, руководители международных регуляторных служб должны обеспечить наличие в своих компаниях надежных систем фармаконадзора и регулярно пересматривать и обновлять свои процессы для поддержания соответствия азербайджанским требованиям.
Требования к маркировке и упаковке в Азербайджане
Фармацевтическая продукция, реализуемая в Азербайджане, должна соответствовать определенным требованиям к маркировке и упаковке, чтобы обеспечить доступ медицинских работников и пациентов к точной и полной информации о продукте.
Требования к языку и содержанию
Вся маркировка и упаковочные материалы для фармацевтической продукции должны быть на азербайджанском языке.
Помимо названия продукта, наименования и адреса производителя, на этикетке и вкладыше в упаковку должна быть указана следующая информация:
- Состав, включая активные вещества и вспомогательные вещества
- Лекарственная форма и сила
- Показания и противопоказания
- Дозировка и способ применения
- Предупреждения и меры предосторожности
- Неблагоприятные реакции
- Условия хранения и срок годности
- Номер партии и срок годности
- Регистрационный номер и дата регистрации
Особые требования к контролируемым веществам и рецептурным препаратам
Фармацевтическая продукция, содержащая контролируемые вещества или требующая рецепта, должна содержать дополнительные элементы маркировки, такие как:
- международное непатентованное название (МНН) контролируемого вещества
- Концентрация контролируемого вещества
- Рецептурный статус продукта (например, «Только по рецепту»).
- Особые требования к хранению и обработке.
Процесс утверждения маркировки и упаковочных материалов
Прежде чем фармацевтический продукт будет допущен к продаже в Азербайджане, этикетка и упаковочные материалы должны быть одобрены Центром аналитической экспертизы лекарственных средств. Владелец разрешения на маркетинг должен представить образцы предлагаемой маркировки и упаковки вместе с регистрационным досье или в рамках запроса на внесение пострегистрационных изменений.
Центр аналитической экспертизы лекарственных средств рассмотрит этикетку и упаковку на предмет соответствия требованиям к языку и содержанию и точного отражения утвержденной рецептурной информации о препарате.
Если органы власти потребуют внести изменения в маркировку или упаковку, держатель разрешения на маркетинг должен переработать материалы и повторно представить их на утверждение.
Правила импорта и экспорта
Менеджеры по международному регулированию также должны быть осведомлены о правилах импорта и экспорта фармацевтической продукции в Азербайджане.
Требования к лицензированию для импортеров и экспортеров фармацевтической продукции
Компании, занимающиеся импортом или экспортом фармацевтической продукции в Азербайджане, должны получить соответствующие лицензии от Министерства здравоохранения.
Основные требования к лицензированию включают:
- Лицензия импортера: Компании, импортирующие фармацевтическую продукцию в Азербайджан, должны получить лицензию импортера. Чтобы получить лицензию импортера, компания должна иметь:
- Зарегистрированное юридическое лицо в Азербайджане
- Подходящие помещения и оборудование для хранения и обработки фармацевтической продукции
- Квалифицированный персонал, включая ответственного фармацевта
- Система контроля качества, соответствующая надлежащей дистрибьюторской практике (GDP)
- Лицензия экспортера: Компании, экспортирующие фармацевтическую продукцию из Азербайджана, должны получить лицензию экспортера. Чтобы иметь право на получение лицензии экспортера, компания должна иметь:
- Зарегистрированное юридическое лицо в Азербайджане
- Действующая лицензия на производство или контракт с лицензированным производителем
- Подходящие помещения и оборудование для хранения и обработки фармацевтической продукции
- Квалифицированный персонал, включая ответственного фармацевта
- Система контроля качества, соответствующая надлежащей производственной практике (GMP) и надлежащей дистрибьюторской практике (GDP).
Процедуры таможенного оформления и документация
При импорте или экспорте фармацевтической продукции компании должны соблюдать процедуры таможенного оформления и предоставлять необходимую документацию, в том числе:
- коммерческий счет-фактуру
- Упаковочный лист
- Сертификат анализа
- Сертификат происхождения
- Регистрационное свидетельство или разрешение на ввоз, в зависимости от обстоятельств
- Другие документы, требуемые таможенными органами
Особые требования к контролируемым веществам и продуктам холодовой цепи
К фармацевтической продукции, содержащей контролируемые вещества или требующей хранения и транспортировки по «холодной цепи», предъявляются дополнительные требования к импорту и экспорту. Для контролируемых веществ компании должны получать разрешение на импорт или экспорт от Министерства здравоохранения на каждую партию.
В случае с продуктами «холодной цепи» компании должны обеспечить хранение и транспортировку продуктов в требуемых температурных условиях и предоставить доказательства контроля температуры при таможенном оформлении.
Заключительные мысли о регистрации фармацевтических препаратов в Азербайджане
Для успешного прохождения фармацевтических процедур в Азербайджане руководителям международных регуляторных органов следует принять во внимание следующие рекомендации:
- Привлекайте местных экспертов и партнеров по регуляторным вопросам: Сотрудничество с местными экспертами и партнерами, такими как Delta Medical, может помочь международным компаниям понять и соблюсти азербайджанские требования, избежать типичных подводных камней и ускорить процесс регистрации.
- Планируйте заранее и выделяйте достаточно времени на регистрацию: Процесс регистрации в Азербайджане может быть длительным и сложным, особенно для инновационных продуктов. Международным компаниям следует заранее планировать и выделять достаточно времени на подготовку, подачу и рассмотрение досье, чтобы избежать задержек при выходе на рынок.
- Приоритет продукции с высоким рыночным потенциалом: Чтобы максимизировать отдачу от инвестиций, международные компании должны приоритизировать регистрацию продукции с высоким рыночным потенциалом в Азербайджане, учитывая такие факторы, как распространенность заболеваний, неудовлетворенные медицинские потребности и конкуренция.
- Обеспечить соблюдение пострегистрационных требований: Международные компании должны создать надежные системы и процессы фармаконадзора для соблюдения пострегистрационных требований в Азербайджане. Регулярный пересмотр и обновление этих систем поможет избежать штрафов и обеспечить бесперебойную работу бизнеса.
- Оставайтесь в курсе изменений и обновлений нормативно-правовой базы: Нормативно-правовая база Азербайджана постоянно развивается, периодически вводятся новые правила и рекомендации. Международные менеджеры по регуляторным вопросам должны быть в курсе этих изменений и соответствующим образом адаптировать свои стратегии и процессы.


